El diagnóstico de enfermedades hereditarias se realiza mediante la obtención de material celular del individuo que se pretende estudiar:
- Extracción de sangre mediante venopunción de un adulto o la punción en el talón de un bebé.
- Extracción de células fetales o placentarias mediante la realización de amniocentesis o biopsias coriales.
- Extracción en el laboratorio de reproducción asistida de células embrionarias de un embrión en fase de mórula o de blastocisto (habitualmente 5º día tras la fecundación).
Sobre este material obtenido se aplican diferentes técnicas genéticas encaminadas a detectar alteraciones en el número o características de los cromosomas, genes o proteínas. Las técnicas varían en función del tipo de diagnóstico que se persigue y de si se tiene una idea previa de lo que se busca, es decir si hay sospecha de la participación de un gen concreto en la enfermedad.
En cualquier caso, éstas son algunas de las utilidades de este tipo de técnicas de diagnóstico genético en la actualidad:
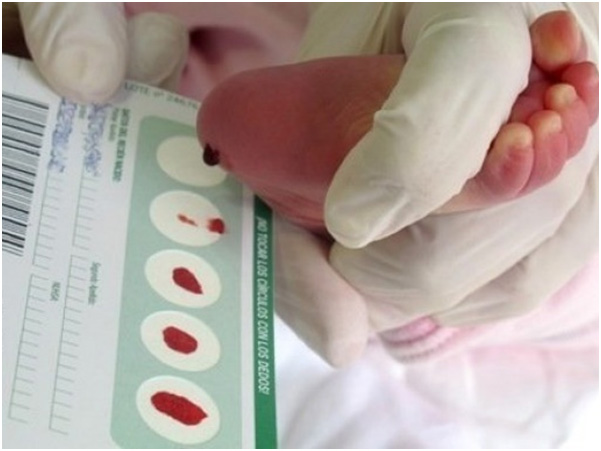
- Cribado neonatal que se realizan de forma rutinaria a los recién nacidos para descartar enfermedades graves que pueden ser tratadas de forma temprana. Un ejemplo de éstas es “la prueba del talón” (Ilustración 1). Consiste en unas punciones en el talón que se realiza a los neonatos para la obtención de una muestra de sangre. Sirve para detectar, entre otras, enfermedades como:
- Hipotiroidismo congénito.
- Hiperplasia Suprarrenal congénita.
- Hiperfenilalaninemias o Fenilcetonuria.
- Hemoglobinopatías congénitas.
Mediante esta prueba se puede detectar graves alteraciones cerebrales y neurológicas, trastornos de crecimiento, problemas respiratorios y otras complicaciones severas para el desarrollo. Es importante su detección porque los niños pueden no presentar signo aparente tras el nacimiento, pero su existencia provoca serios problemas de salud en los primeros meses de vida.
- Diagnóstico de enfermedades hereditarias, mediante estas técnicas se confirma un diagnóstico clínico ante una seria de signos y/o síntomas compatibles con una enfermedad concreta. En este caso, la presencia de una serie de signos y síntomas nos hace sospechar una enfermedad genética concreta. Por ejemplo, la presencia en un recién nacido de retraso en el crecimiento, ausencia de deposiciones durante las primeras 24 a 48 horas de vida y/o piel con sabor salado así como resultados anormales en determinadas pruebas diagnósticas (el examen del tripsinógeno inmunorreactivo o el test del sudor o prueba de cloruro en el sudor) nos puede hacer sospechar que esté afecto de una Fibrosis Quística: la confirmación vendrá mediante la secuenciación del gen CFTR para saber si tienen la enfermedad.

- Detección de portadores de enfermedades genéticas. Este tipo de pruebas permite saber si una persona es portadora del alelo, de una de las 2 versiones del gen, responsable de una enfermedad hereditaria que se manifiesta cuando hay presentes dos de estos alelos (enfermedad hereditaria de tipo recesivo). Son útiles en el caso de personas que tienen una historia familiar de una enfermedad hereditaria recesiva ya que hace posible estimar el riesgo a tener descendencia afectada. Así, se utilizarían para estudiar a los familiares (tíos, primos, etc.) de un niño afecto de Fibrosis Quística para comprobar cuáles son portadores del gen enfermo (mutado) y, por tanto, son susceptibles de transmitir la enfermedad a su descendencia si coincidieran con otra pareja portadora de la misma enfermedad.
- Prevención de la aparición de enfermedades genéticas que tienen una edad de presentación tardía. Estas pruebas predictivas o presintomáticas detectan la presencia de mutaciones causales de una enfermedad antes de que ésta se manifieste. Son útiles para personas que tienen familiares con una enfermedad hereditaria de aparición tardía, y que no muestran síntomas de enfermedad en el momento de realizarse la prueba. Por ejemplo, las mutaciones de los genes BRCA que predisponen a presentar cáncer de mama y/u ovario se pueden diagnosticar y aplicar cirugías reductoras del riesgo de padecer cáncer de mama y ovarios antes de que se presenten (Ilustración 2).
- Diagnóstico prenatal con el que se analiza el material hereditario del embrión o el feto antes del nacimiento.
Para conseguir el material del feto se utilizan técnicas invasivas como la amniocentesis o la biopsia de vellosidades coriales que tienen un riesgo de pérdida de la gestación no despreciable (en torno al 1%). Es por ello por lo que no se realizan a todos los embriones o fetos, sino que se realiza previamente una selección o “cribado” de aquellos embriones o fetos que podrían tener una alteración genética. Esta selección puede realizarse en función de:- Ecografía morfológica fetal en la que se detectan malformaciones o determinados “marcadores ecográficos” que se asocian con alteraciones genéticas (por ejemplo, la ausencia de hueso nasal o los huesos largos de una longitud marcadamente inferior a la normal se asocian con la trisomía 21 o síndrome de Down) y, por tanto, hacen sospechar que el feto esté afecto de alguna alteración genética.
- “Cribado combinado”: la realización de un cálculo del riesgo de que el feto pueda padecer una alteración cromosómica en función de determinados factores: edad, resultados analíticos y determinadas medidas fetales como la translucencia nucal. Cuando el riesgo de la cromosmopatía es igual o superior al riesgo de aborto en las técnicas invasivas se indicaría la técnica invasiva.
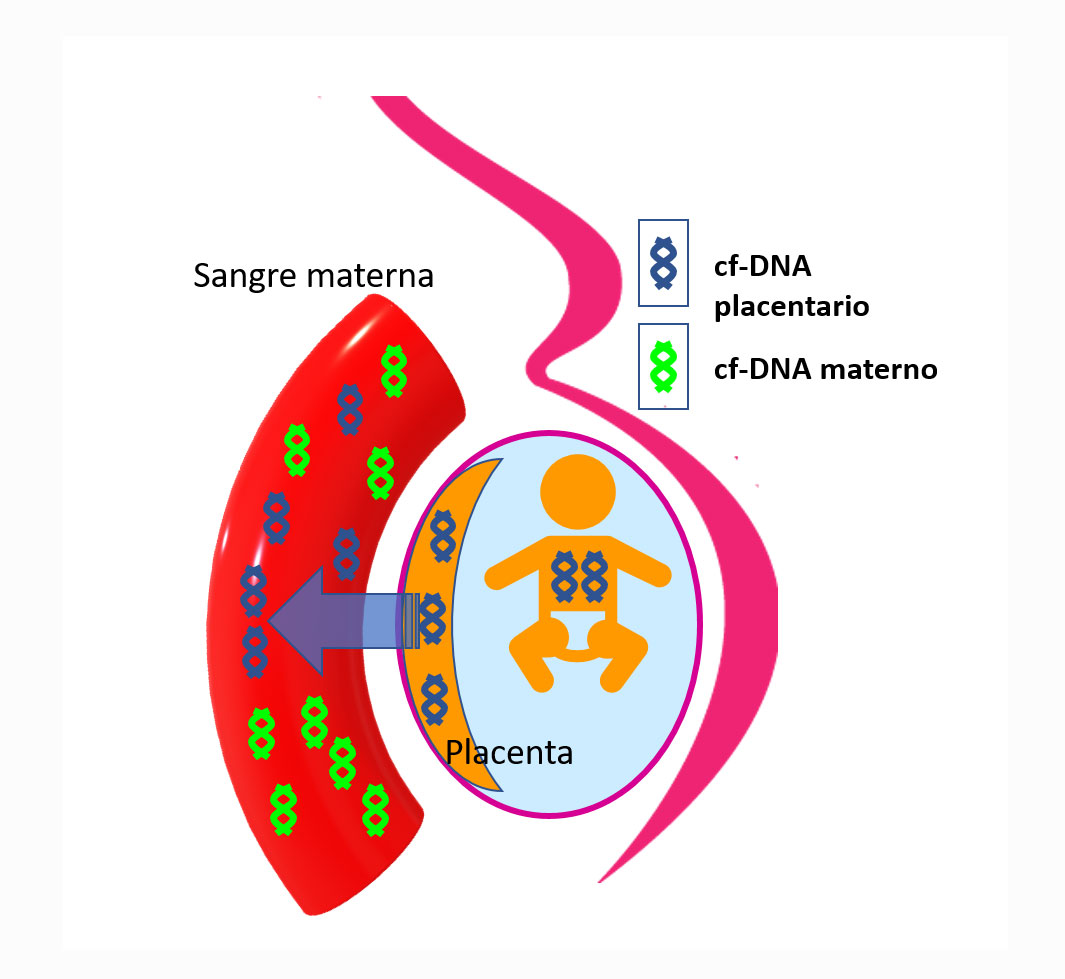
- “Test de Diagnóstico Prenatal No Invasivo (Verirref)”: mediante el análisis del ADN fetal libre en la sangre materna (Ilustración 3) se valora el riesgo de existencia de alteraciones cromosómicas (aneuploidías, etc.) o alteraciones de genes concretos (microdeleciones relacionadas con síndromes genéticos). Actualmente, se puede estudiar, al menos, las alteraciones numéricas de los 24 pares de cromosomas y las microdeleciones de las siguientes enfermedades genéticas: Síndrome de Di George (Microdeleción 22q11.2), Síndrome de Angelman/Prader Willi (Microdeleción 15q11.2), Microdeleción 1p36, Síndrome de Wolf-Hirschhorn (Microdeleción 4p-) y Síndrome de Maullido de Gato o Cri du Chat (Microdeleción 5p).
Tras la presencia de un riesgo elevado en cualquiera de los métodos de cribado se plantea la necesidad de realizar una amniocentesis o una biopsia corial para obtener material genético que será analizado mediante diversas técnicas genéticas en el laboratorio: técnicas tradicionales de análisis citogenéticos de banda como Giemsa (cariotipo convencional), FISH o hibridación fluorescente in situ y, más recientemente, hibridación genómica comparativa o CGH (Comparative Genomic Hybridization)
- Diagnóstico genético preimplantacional que permite identificar alteraciones genéticas y cromosómicas en embriones obtenidos por fecundación in vitro antes de su implantación en el útero materno.
Técnicamente consiste en tomar unas pocas células de un embrión conseguido a través de una fecundación in vitro (FIV) o inyección intracitoplasmática (ICSI). Sobre esas células obtenidas de realizará un análisis genético determinado dependiendo lo que se vaya buscando: cromosomopatías, determinadas mutaciones genéticas, etc (Ilustración 4).
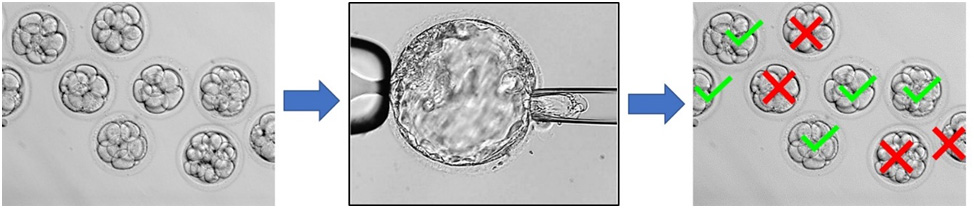
Mediante esta técnica los embriones enfermos, portadores de la alteración genética buscada, son desechados y sólo se transferirán en el útero materno los embriones sanos.
Sin duda alguna, en los próximos años el desarrollo de todos estos campos va a ser exponencial. Se ampliarán el número de enfermedades diagnosticables, se reducirán sus costes, se ampliarán las técnicas, etc.


